| Список статей | Контакт с автором | English | RUS=Win1251 |
ВЛИЯНИЕ UV-B НА ПРОЛИФЕРАЦИЮ КАЛЛУСНОЙ КУЛЬТУРЫ ПШЕНИЦЫ
Лапшин П.В., Загорска Н.А.*, Бутенко Р.Г.
The scientific chief - Raisa G. Butenko
Институт фзиологии растений им.К.А.Тимирязева Российской АН, Москва; 127276, Ботаническая, 35,
*Институт Генетики им.А.Г.Костова Болгарской АН, София; 1113.
В результате антропогенного влияния проиcходят глобальные изменения окружающей среды. Все большее внимание в последние годы привлекает к себе проблема истощения стратосферного озонового слоя, и как следствие этого увеличение количества ультрафиолетовой радиации, достигающей поверхности Земли. (Caldwell et al., 1989, Green et al., 1974, 1980). Установлено снижение концентрации озона над Южным и Северным полюсами, имеются данные о озоновых дырах у Южного полюса. Снижается концентрация озона и над Северным полушарием; резкое утоньшение озонового слоя показано над тропиками Африки, Южной Америки, над водами Антарктики и экваториального пояса.
Ультрафиолетовая область солнечной радиации является одним из стрессовых факторов окружающей среды, и понимание того, каким образом живые организмы реагируют на данный фактор, позволит оценить опасность увеличения ультрафиолетовой радиации у поверхности Земли в диапазоне длин волн 280-320 нм (UV-B), (Sisson, Caldwell, 1977; Frederick et al., 1989). Ультрафиолетовое излучение приводит к морфологическим нарушениям (Beggs et al., 1986), тормозит линейный рост стебля, уменьшает коэффициент кущения и число колосоносных побегов пшеницы (Шульгин и др., 1990), снижению биомассы, повреждениям генеративного аппарата (Akihisa et al., 1991) и гормональным сдвигам у растений (Lindoo et al., 1979; Акназаров, 1976; Жалилова и др., 1993; Жалилова, 1993).
Обсуждается возможность культур in vitro для изучения действия ультрафиолета, в том числе заманчиво использовать культивируемые клетки как модель взаимодействия излучения с организмами. Важным прикладным аспектом здесь было бы получение устойчивой к UV-B излучению клеточных вариантов и еще заманчивее - растений.
В связи с увеличением ультрафиолетовой радиации в диапазоне длин волн 280-320 нм в солнечном спектре, доходящем до поверхности Земли, было интересным определить влияние ультрафиолетового облучения в этой области на пролиферацию каллуса яровой мягкой пшеницы T. aestivum.
МАТЕРИАЛЫ И МЕТОДЫ
Для настоящего исследования использовали первичный и пассируемый каллус двух генотипов яровой мягкой пшеницы Triticum aestivum - сорт "Таежная" и линию "Фотос". Сорт Таежная выведен в Красноярском НИИСХ методом индивидуального отбора из третьего поколения гибридной комбинации К-441 (Л-330 х М-341). Достоинство сорта - скороспелость, созревает раньше стандарта на 2-11 дней. Линия Фотос (Л 40959) получена индивидуальным отбором из гибридной популяции от скрещивания сортов Московская 35 и Жница в Башкирском НИИЗиС. По качеству зерна относится к ценным пшеницам. Потенциальная урожайность - 45-50 ц/га. Среднеранняя.
Для получения каллусной ткани семена стерилизовали 0,1% сулемой в течение 10 минут, замачивали в течение 16-24 часов, после чего вычленяли зародыши и помещали их щитком вниз на поверхность питательной среды в чашки Петри диаментром 9 см по 12-18 штук в каждую. Питательная среда: макро- и микросоли по МS с добавлением 10мг/л АgNОз, 20 мг/л аскорбиновой кислоты и 2,5 мг/л 2,4-Д.
Зародыши культивировали в фитостатной камере при темпиратуре 20оС и освещенностью 5Klx. Первичный каллус пассировали каждые 28 дней на свежую среду того же состава. Для стимуляции процессов стеблевого органогенеза заменяли 2,4-Д в среде на 0,5 мг/л ИУК + 1,0 мг/л БАП.
Для получения излучения в UV-B области использовали газоразрядную ртутную лампу высокого давления типа ПРК-2, мощностью 400Вт, имеющую линейчатый спектр в широком диапазоне длин волн, включающий UV-C (линии 254, 265nm), UV-B (линии 289, 292, 297 и 302nm), а также UV-A (365nm) и видимый свет (менее 30,2Вт/м2). Для отсечения коротковолнового УФ-С излучения использовали стеклянные фильтры "Anumbra", пропускающие излучение с длиной волны больше 293nm. Около 300nm пропускание составляет 10% и 50% на 310nm. Начиная с 340nm и до длинноволновой границы видимого спектра этот материал пропускает более 90% излучения. Интенсивность излучения регулировали изменяя расстояние от источника. Облучение проводили в камере фитотрона без присутствия естественного облучения. В первых экспериментах использовались следующие интенсивности излучения: 1,66 и 0,74 Вт/м2 (что соответствовало 25 и 50 см от лампы), в последующих 1,11; 0,74; 0,55; 0,46 и 0,39 Вт/м2 по UV-B (соответственно 40, 50, 60, 70 и 80 см от лампы) в течение 2 часов каждые сутки в течение всего периода культивирования примерно в середине 16-ти часового фотопериода облучения белым светом (интенсивность 5Klx). Контроль - культура под стеклом, не пропускающим ультрафиолет на расстоянии 50-60 см от лампы.
Результаты оценивали в конце каждого пассажа по количеству образовавшихся каллусов из первичного экспланта и по их массе, которая учитывалась индивидуально для каждого экспланта, что позволило выделить клеточные линии, ведущие свое происхождение от одного первичного экспланта.
В полученных нами клеточных линиях было определено суммарное содержание фенолов спектрометрическим методом и суммарное содержание аминокислот методом газо-жидкостной хроматографии.
РЕЗУЛЬТАТЫ
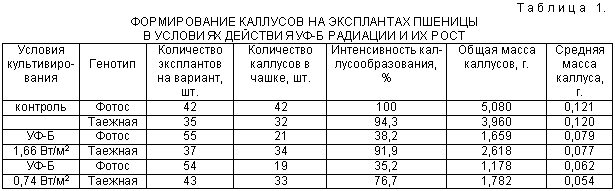
При культивировании зародышей на поверхности питательной среды в течение первых 1-3 дней наблюдали значительное набухание первичного экспланта. На 2-4 день культивирования у 30-40% первичных эксплантов отмечали начало каллусообразования, а к 10-14 дню каллус образовывали уже 98-100% эксплантов.
Сначала образовывался рыхлый, белый, водянистый, слегка пленчатый каллус из осевой части зародыша (в промежутке между щитком и апексом). На 7-10 день на поверхности шитка начинал образовываться и желтый глобулярный каллус. Иногда наблюдалось развитие проростков из первичного экспланта. Доля проростков достигала 40-60% и зависела от техники выделения: аккуратно выделенные, неповрежденные зародыши с большей частотой образовывали проросток (табл. 1). Наличие проростка положительно сказывалась на массе первичного каллуса, но отрицательно на его морфогенетическом потенциале.
Характеристика каллусной ткани яровой мягкой пшеницы Triticum aestivum
(сорт "Таежная" и линия "Фотос")
Образующийся каллус обычно был нескольких, хорошо различимых типов, соотношение которых зависит от условий культивирования, возраста культуры, частоты пассирования и индивидуальной массы каллусных агрегатов:
Относительно рыхлый беловато-желтый, оводненный, без признаков органогенеза. Состоит из небольших (3-7 мм в диаметре) шарообразных или яйцеобразныхструктур с гладкой поверхностью, объединенных между собой. Этот тип каллуса имеет умеренный прирост массы (50-200% на пассаж). Такой каллус в зависимости от действия факторов культивирования может постепенно трансформироваться в неоторые другие типы:
Первый тип каллуса при достижении им некоторой массы ((300мг) или при уменьшении концентрации 2,4-Д легко образует корни. Обычно появление корней сопровождается сильным увеличением прироста массы каллуса (5-7 кратный пророст за пассаж), т.к. кончики корней, достигая питательной среды, содержащей 2,4-Д, вновь образуют каллус. Таким образом такая структура состоит из корней покрытых массой вновь образованного первичного каллуса. Основания корней часто зеленеют, но первичный каллус из кончиков корней всегда серебристо-белый. Стеблевой органогенез в такой системе отсутствует.
Первый тип каллуса иногда (в зависимости от типа первичного каллуса; возраста культуры и типа и количества регуляторов роста в среде) образует полые сферические образования, на внутренней поверхности которых закладываются ярко-желтые или зеленеющие участки дифференцированной ткани. Иногда целостность этих образований нарушается и в области "разлома" хорошо заметны зеленые плоские листообразные образования, между которыми через некоторое время образовывались апексы побегов с настоящими листьями. Такие каллусы через некоторое время образовывали множество корней.
Иногда на поверхности каллуса первого типа возникают очень мелкие зеленые "точки", которые с вероятностью около 70-80% развиваются в морфологически нормальные побеги. Корнеобразование наблюдается только когда побег уже полностью сформируется.
С увеличением количества пассажей каллус первого типа постепенно трансформируется в следующий тип - мелкоагрегированный грязно-желтый рассыпчатый каллус, состоящий из малосвязанных между собой глобул различного диаметра - от 0,5 до 3 мм. Более крупные глобулы часто покрыты корнями. Такой каллус интенсивно нарастает, но регенерации морфологически нормальных растений не дает.
На каллусной культуре, подвергающейся длительному периодическому воздействию UV-B опрелеляли ростовые показалели: процент каллусообразования, выживаемость каллусов при облучении в течении нескольких субкультивирований и прирост каллусной массы. Наши наблюдения показали ингибирование прироста каллусной культуры и уменьшение выживаемости в зависимости от интенсивности излучения и генотипа (табл. 2).

Под действием ультрафиолета уменьшается как процент образовавшихся каллусов, так и их масса. Процент каллусов значительно упал у линии Фотос (от 100% в контроле до до 38% при дозе 0,74 Вт/м2 и до 36% при дозе 1,66 Вт/м2). Процессы каллусообразования у Таежной оказались менее подвержены действию UV-B (каллусообразование от 95% в контроле до 91% при 1,66 Вт/м2 и до 74% при 0,74 Вт/м2. Негативное воздействие UV-B на неорганизованный рост хорошо видно из результатов взвешивания: масса каллусов обоих генотипов уменьшается линейно при увеличении дозы UV-B по сравнению с контролем. Так при 1,66 Вт/м2 масса каллуса Фотоса составляла в среднем 83% от контроля, а Таежной - 72,8%. А при 0,74 Вт/м2 -75% и 63,5% соответственно (табл. 2).
Таким образом использованные в этих опытах генотипы по-разному реагируют на присутствие фона UV-B. У Фотоса наблюдается значительное снижение числа образовавшихся каллусов, тогда как их масса уменьшается не так сильно, как у Таежной. В тоже время у Таежной процент каллусообразования в присутствии UV-B остался довольно высоким, но масса образовавшихся калусов была ниже, чем у Фотоса при одинаковой дозе UV-B.
При дальнейшем культивировании выяснилось, что выбранные дозы (1,66 и 0,74 Вт/м2) оказались летальными для обоих генотипов - наблюдалось только образование первичного каллуса из тканей экспланта. При последующих пересадках этой каллусной ткани без облучения прироста каллусной массы не наблюдалось, хотя по внешнему виду каллусы сохраняли характерный для живой ткани светло-желтый цвет. Кроме того действие UV-B в таких дозах полностью блокировало процессы стеблевого органогенеза в неорганизованно растущей ткани. Поэтому мы уменьшили интенсивность облучения и ввели более дифференцированную шкалу. Использовали интенсивности 1,11; 0,74; 0,55; 0,46 и 0,39 Вт/м2 по UV-B (что соответствовало 40, 50, 60, 70 и 80 см от источника излучения). Облучение производили в течение 2 часов каждый день примерно в середине 16-ти часового фотопериода освещения белым светом. Было выяснено, что доза 1,11 и 0,74 Вт/м2 UV-B оказывала летальное действие на каллус сорта Таежная: после месяца культивирования при облучении сохранили рост 22,7% экспланта, после второго месяца - 0% (табл. 3).
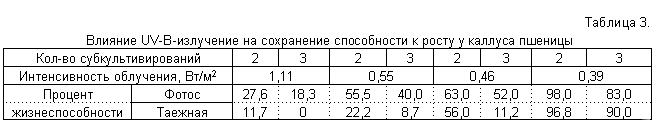
При дозе 0,55 Вт/м2 после 2 субкультивирований были выделены 11,2% жизнеспособных колоний, которые образовывали высокий прирост массы. Линия Фотос оказалась менее подверженной действию UV-B. Даже при дозе 1,11 Вт/м2 наблюдался некоторый прирост массы - 27,6% после 1 месяца и 18,9% после второго.
В результате облучения в течение трех последовательных субкультивирований для линии Фотос удалось выделить несколько клеточных линий, способных сохранять рост на уровне контроля в присутствии UV-B - облучения. Эти линии выращивали в дальнейшем еще в течение 3 субкультивирований без UV-B-облучения при 16-ти часовом фотопериоде (белый свет), после чего в их тканях определяли суммарное содержание фенолов (табл. 4).
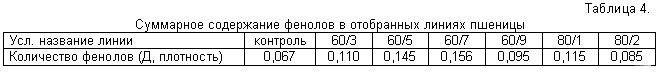
Из таблицы видно, что во всех отобранных линиях содержание фенолов выше, чем в контроле (в 2 случаях почти в 2 раза).
Также в этих линиях определяли содержание суммы свободных аминокислот (табл. __). Это определение показало значительные количественные отличия в содержании большинства аминокислот по сравнению с контролной популяцией. Так содержание фенилаланина (предшественника фенолов), аспарагина, глутаминовой к-ты, орнитина и лизина было почти во всех исследованных линиях выше, чем в контроле; а аланина меньше, чем в контроле.
ЗАКЛЮЧЕНИЕ
Наши опыты по селекции избранных генотипов пшеницы к повышению уровня UV-B показывают, что возможно получение хорошо растущей клеточной линии, устойчивой к действию этого фактора. Эти линии имеют изменения в фенольном метаболизме. Планируется изучить возможность получения растений-регенерантов из толерантных клеточных линий и оценить их устойчивость к исследуемому фактору.
ЛИТЕРАТУРА
Sisson W.B., Caldwell M.M. (1977) Atmospheric ozone depletion reduction of photosysthetic and growth of a sensitive higher plant exposed to enhanced UV-B radiation // Exp.Bot., 28(104), 691-697.
Frederick J.E., Snell H.E., Haywood C.(1989) Solar ultraviolet radiation at the earths sufase //Photochem.Photobiol., 50(8), 443-450.
Beggs C., Shneider-Ziebert U.,Wellman.(1986) UV-B radiation and adaptive mechanisms in plant // Photoch.Photobiol., 3 , 243-255.
Шульгин И.А., Забиров Р.Г., Щербина И.П., Толибеков Д. Т. (1990) О роли ультрафиолетовой радиации высокогорных районов в строении побега и продуктивности пшеницы // Биол. науки, N7, 107-118.
Akihisa T., Kosaku T.,Takeo O. (1991), Light induced antocyanin reduces the extent of damade to DNA in UV-irradiated // Plant Cell Physiol., 32(4), 541.
Lindoo S.S., Seeley S.D., Caldwell M.M.(1979) Efffects of ultraviolet-B radiation stress on the Abscisic Asid status of Rumex patientia leaves //Phys.Plant., 45(1), 67- 75.
Акназаров О. (1976) Активность эндогенных регуляторов роста у растений высокогорий Памира // Автореф. на соискание ученой степени канд. биол. наук. Душанбе.
Жалилова Ф.Х. (1993) Влияние УФ-Б радиации на содержание фитогормонов и рост мутантных линий арабидопсиса // Автореф. на соиска ние ученой степени канд. биол. наук. Москва.
Жалилова Ф.Х., Ракитина Т.Л., Леасов П.В., Кефели В.И. (1993) Действие ультрафиолетовой радиации (УФ-Б) на рост и выделение этилена из трех генетических линий Arabidopsis thaliana // Физ. раст. 40(8), 764-769.
Murashige T., Scoog F. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures - Physiol plantarum, v. 15, p. 473-497.
|
|