| Список статей | Контакт с автором | English | RUS=Win1251 |
СИНТЕЗ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ КАЛЛУСНЫМИ КУЛЬТУРАМИ
TRITICUM AESTIVUM ПОД ВОЗДЕЙСТВИЕМ УФ-Б
Лапшин П.В., Загоскина Н.В., Бутенко Р.Г.
Институт физиологии растений им. К.А. Тимирязева РАН, Москва, Россия, (095)977-94-33, E-mail: phenolic@ippras.ru
Ультрафиолетовое излучение (УФ) является мощым стрессорным фактором для живых систем, в том числе растений [9]. Под воздействием УФ-излучения изменяются многие морфо-физиологические и биохимические параметры растительных клеток. Эти изменения зависят от ткани, стадии развития организма, его генотипа и условий облучения: длительности и спектрального состава излучения. Различают коротковолновое УФ-излучение - с длиной волны от 200 до 280 нм (так называемое УФ-С), средневолновое - 280-315 нм (УФ-В) и длинноволновое - 315-380 нм (УФ-А).
Излучение с различной длиной волны по-разному воздействует на растительные клетки. Мишенью коротковолновой УФ-С радиации в клетке является ДНК, мишенью УФ-Б - преимущественно белки [1]. УФ-А обладает в основном фиторегуляторным действием и определяет изменение метаболизма растительных тканей при стрессовом воздействии. Одако в высоких дозах УФ-А также способен вызывать повреждения в живых клетках.
В природных условиях солнечное УФ-А излучение достигает земной поверхности, а УФ-Б и УФ-С задерживаются компонентами атмосферы [13, 14]. В последние десятилетия внимание ученых многих стран привлекло возможное увеличение поступления УФ-Б (280-320 нм) к земной поверхности в результате сокращения коцентрации основного протектора проникновения УФ-излучения в атмосфере - газа озона (О3), вызванное антропогенными выбросами веществ, могущих разрушать озон. В результате земной поверхности будет достигать не только УФ-А, но и УФ-Б, обладающий значительным стрессовым и мутагенным эффектом на растения. Поэтому в настоящей работе мы исследовали совместное действие УФ-А и УФ-Б на культивируемые in vitro растительные ткани.
В качестве защиты от негативного действия больших доз природного ультрафиолетового излучения, растения выработали ряд приспособительных механизмов. Одним из основных механизмов, предотвращающих проникновение УФ-излучения внутрь клеток, является синтез флавоноидных пигментов и других фенольных соединений [5]. Это их действие обусловлено способностью к поглощению в коротковолновой части спектра [17, 18, 19]. Подобные изменения не могут происходить без активизации фенольного метаболизма в тканях, так как флавоноидные пигменты и компоненты клеточных стенок являются продуктами фенольной природы. Степень повреждающего действия ультрафиолетового облучения зависит от способности синтезировать протекторы УФ-облучения - вещества, поглощающие УФ излучение: антоцианы, флавоноиды и др. [21, 9]. Предполагают, что большинство растений отвечают на УФ-облучение активацией флавоноидного пути биосинтеза. Индукция синтеза флавоноидов и антоцианов при УФ-облучении показана для многих видов растений [3, 4, 7, 8, 10, 12, 15, 16, 24].
Флавоноиды и антоцианы накапливаются в эпидермальном слое растительной ткани, который защищает таким образом растения от действия ультрафиолета [25, 26]. Эпидермис блокирует передачу от 95 до 99% приходящей УФ-радиации [22]. Индукция флавоноидов в проростках ржи может предотвратить УФ-Б индуцируемое повреждение фотосинтетического аппарата, что подтверждает факт защитной функции этих пигментов [25].
Фенилпропаноидный путь катализируется фенилаланин-аммиак-лиазой (ФАЛ), а единственный ключевой фермент синтеза флавоноидов - халкон-синтаза (ХС). Делеционный анализ ХС-промотора идентифицировал сегмент ДНК, который реагирует на световую индукцию этого гена у петрушки [23]. УФ-облучение быстро индуцировало экспрессию ФАЛ и ХС у арабидопсиса, при котором максимальное накопление обоих траскриптов наблюдалось после 6-часовой обработки ультрафиолетом [20]. Причем у мутантного по синтезу флавоноидов типа растений наблюдалась высокая чувствительность к УФ-излучению по сравнению с диким типом. Показано, что добавление рибофлавина в суспензию клеток петрушки увеличивает УФ-Б индукцию халкон-синтазы. Это дает повод предполагать, что УФ-Б рецептор может быть флавином [11].
ОБЪЕКТЫ И МЕТОДЫ
Объектом наших исследований являлись устойчивые к УФ-Б клеточные линии каллусной ткани яровой мягкой пшеницы Triticum aestivum линии Фотос (Л 40959) Башкирского НИИЗиС. Каллусные ткани подвергались селекции на устойчивость к средневолновому ультрафиолетовому излучению. В работе изучали влияние совместного действия УФ-А и УФ-Б на на синтез фенольных соединений у неорганизованно растущей каллусной ткани. При облучении ультрафиолетом использовали аналог ртутной лампы ПРК-2, излучающей в широком диапазоне длин волн, в сочетании с фильтрами, убирающими УФ-С излучение. В качестве фильтров использовали стеклянные фильтры "Anumbra". Для биохимического анализа использовали: линии, отобранные при интенсивности облучения 0,55 Вт/м2 по УФ-Б и 6,15 Вт/м2 по УФ-А далее обозначаются буквой "В" и порядковым номером линии, а линии, полученные при 0,39 Вт/м2 по УФ-Б и 4,42 Вт/м2 по УФ-А - буквой "Н".
Каллусная ткань, использованная в работе, была получена из незрелых зародышей. Для поддержания культуры использовали модифицированную агаризованную питательную среду с минеральными солями по рецепту Мурасиге и Скуга с добавлением витаминов: глицина (2мг/л), никотиновой к-ты (0,5 мг/л), пиридоксина-HCl (0,5 мг/л), тиамина-HCl (1 мг/л), мезоинозита (100 мг/л), аспарагина (150 мг/л), аскорбиновой к-ты (20 мг/л); 10мг/л AgNO3, и 2,5 мг/л 2,4-Д. Сахароза присутствовала в среде в концентрации 2%. pH среды корректировался в пределях 5,6-5,8. Ткани выращивали в камере фитотрона, при t=20оС, освещенности ~5KLx. Облучали как первичный, так и пересадочный каллус, непосредственно в чашках Петри на протяжении всего периода культивирования. Контрольная ткань того же возраста (первичный каллус и первые субкультивирования) находилась под стеклом, непрозрачным для ультрафиолета.
Определение суммы растворимых фенольных соединений проводили по Запрометову [2] пектрофотометрированием этанольного экстракта растительного материала, обработанного реактивом Фолина-Дениса при 725 нм. Анализ проводили через 6 месяцев после прекращения облучения на пассируемой каллусной ткани, подвергавшейся облучению. Анализ фенольных соединений проводили методом хроматографии в тонком слое микрокристаллической целлюлозы в системе Н-бутанол - уксусная кислота - бутанол (49:12:28 по объему). Идентификацию выделенных соединений проводили на основе их флуоресценции в ультрафиолете по значениям Rf сравнительно с метчиками, по качественным реакциям с FeCl3 и K3[Fe(CN6)]) [152].
Анализ содержания свободных аминокислот проводили с помощью автоматического анализатора аминокислот (ААА-339М, фирма "Kovo", Чехия) [153].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфо-фиологичекие наблюдения. Каллусные ткани яровой мягкой пшеницы T. aestivum сорта Таежная и линии Фотос первоначально белые, водянистые, пленчатые, несколько позднее, на 7-10 день после начала каллусообразования, формируется желтый глобулярный каллус. Интенсивность каллусообразования высокая. Пассируемые каллусные ткани, как правило, относительно рыхлые, беловато-желтого цвета, оводненные, в большинстве случаев без признаков как стеблевого органогенеза, так и ризогенеза, Ткани состоят из небольших (3-7 мм в диаметре) шарообразных или яйцеобразных глобул с гладкой поверхностью, объединенных между собой. В зависимости от воздействия факторов культивирования такая каллусная ткань могла постепенно становиться ризогенной или проявлять признаки стеблевого органогенеза. Факторами культивирования являлись: абсолютный возраст культуры, (количество пассажей, прошедших со дня введения первичного экспланта в культуру in vitro), индивидуальная масса каллусного агрегата, присутствие и соотношение регуляторов роста и элементов питания в среде культивирования. При культивировании в стандартных условиях каллусная культура проявляла стабильность и в течение двух лет ее морфофизиологические характеристики существенно не изменялись.
Под воздействием УФ-облучения и при уведичении длительности облучения, количество образовавшихся каллусов из первичного экспланта и их масса у обоих генотипов. При длительном облучении каллусная ткань, сохраняющая жизнеспособность, имеет индекс роста порядка 2,1-2,6. Каллусная ткань сорта Таежная характеризовалась несколько большей скоростью прироста биомассы, чем у линии Фотос. Исследование роста клеточных линий пшеницы, устойчивых к действию УФ-Б радиации показало, что резкие различия по этому показателю у отобранных линий и контрольной культурой отсутствуют. Это может быть связано с тем, что устойчивые к УФ-облучению клеточные линии сохранили многие параметры, свойственные неорганизованно растущей каллусной культуре исходных генотипов.
Морфо-физиологическая оценка клеточных культур показала, что они состояли из клеток паренхимного типа, имеющих крупную вакуоль, занимающую большую часть клетки. Помимо паренхимных клеток в структуре каллусов часто наблюдали формирование меристематических очагов. Во многих линиях встречаются также группы трахеидальных элементов. Сравнение размеров клеток показало, что величина клеток у всех устойчивых к УФ-Б клеточных линий меньше, чем у контрольной культуры. Так у линий, полученных при низкой интенсивности УФ-Б размер клеток составлял в среднем 76,3% от контроля, а у линий, полученных при большей интенсивности УФ-Б - 81,8%. Нами были обнаружены различия в толщине клеточных стенок между контрольной культурой и линиями, отобранными на устойчивость к УФ-Б облучению, а также между этими линиями. Эти различия зависели от дозы УФ-Б. У линий, полученных в результате селекции при более высокой дозе, клеточная стенка примерно на 9% больше, чем у линий, полученных при низкой дозе, и на 17% - по сравнению с контролем.
Таким образом мы можем предположить, что УФ-Б вызывает изменения в морфологии клеток, главным образом отражающееся как на формировании их клеточных стенок, в сторону утолщения, так и на размер клеток.
По-скольку мы обнаружили изменения в толщине клеточных стенок у отселектированных линий, а одним из основых веществ оболочек клеток является лигнин (полимер фенольной природы), мы решили проверить его наличие в каллусных культурах. Нами было установлено, что лигнин образуется в клеточных культурах. В основном он накапливается в неравномерно утолщенных стенках паренхимных клеток и в трахеидальных элементах. Была отмечена неодинаковая реакция на лигнин между полученными линиями. В контрольном варианте лигнин обнаруживается крайне редко. В случае линий, полученных при селекции, реакция на лигнификацию значительно более выражена. При этом наибольшее образование лигнина характерно для линий Н2 и В5.
Биохимическая характеристика. Ультрафиолетовая радиация оказывает влияние на биохимические показатели растений. Для выяснения того, влияет ли ультрафиолетовое излучение на биохимические показатели неорганизованно растущих тканей пшеницы отобранных на устойчивость к УФ-Б линий, определяли содержание свободных аминокислот, содержание суммы растворимых фенольных соединений и их качественный состав.
Измерение содержания свободных аминокислот в отобранных линиях пшеницы показало существенное варьирование их количественного состава между изученными линиями. В тоже время что содержание большинства аминокислот в отселектированных штаммах в 1,5-2 раза выше, чем в контроле, также отмечено более высокое их содержание у штаммов, полученных при низкой дозе УФ излучения. Так содержание аланина, (-аминомасляной кислоты и орнитина было в 3 раза выше у линии Н1 по сравнению с контролем, а содержание треонина, глутамина, тирозина и фенилаланина во всех изученных линиях мало отличалось от контроля.
Для выяснения того, влияет ли ультрафиолетовое излучение на биохимические показатели неорганизованно растущих тканей пшеницы отобранных на устойчивость к УФ-Б линий, определяли содержание свободных аминокислот, содержание суммы растворимых фенольных соединений и их качественный состав.
Измерение содержания свободных аминокислот в отобранных линиях пшеницы показало существенное варьирование их количественного состава между изученными линиями. В тоже время что содержание большинства аминокислот в отселектированных штаммах в 1,5-2 раза выше, чем в контроле, также отмечено более высокое их содержание у штаммов, полученных при низкой дозе УФ излучения. Так содержание аланина, (-аминомасляной кислоты и орнитина было в 3 раза выше у линии Н1 по сравнению с контролем, а содержание треонина, глутамина, тирозина и фенилаланина во всех изученных линиях мало отличалось от контроля.
Изменения в содержании свободных аминокислот свидетельствуют об изменениях на биохимическом уровне, которые связаны с действием УФ-Б на неорганизованно растущие клеточные культуры.
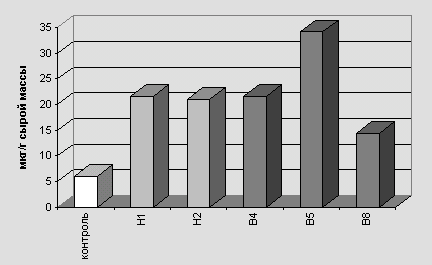
Определение содержания фенольных соединений в каллусных культурах пшеницы выявило различия в количестве синтезируемых фенолов. Наиболее низкое их количество характерно для контрольных вариантов (табл. 1). Во всех случаях у культур, подвергнутых действию УФ-Б, содержание фенольных соедений было в 5-7 раз выше (рис. 1). Наибольшее накопление фенольных соединений отмечено у линии В5.
Таблица 1.
Вариант | контроль | Н1 | Н2 | В4 | В5 | В8
| ФС, мкг/г сырой массы | 6 | 21.6 | 21 | 21.6 | 34.2 | 14.4
| |
Изучение качественного состава синтезируемых фенольных соединений на основании данных тонкослойной хроматографии показало, что в каллусных культурах состав этих веществ довольно близок (рис. 2).
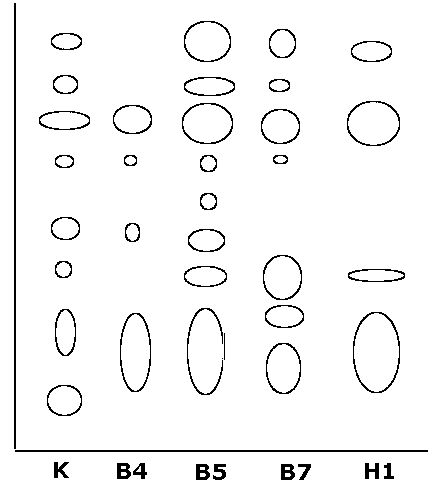
В большинстве случаев в составе фенольного комплекса присутствуют 4-5 соединений. Большее разнообразие этих веществ наблюдается у линий Н2 и В5. Вариант Н1, В4 и В7 несколько беднее по составу фенольных соединений. Нами не было отмечено изменения содержания растворимых фенольных соединений от длительности пассирования облученных каллусных тканей после прекращения воздействия. Таким образом можно заключить, что повышение количества растворимых ФС носит стабильный характер и является одной их стабильных характеристик полученных клеточных линий.
Судя по предварительным данным, эти вещества относятся к фенол-карбоновым кислотам - наиболее распространенным в растениях представителям этих веществ. Наши данные показывают, что каллусные культуры, полученные в результате селекции к УФ-Б отличаются лишь по количеству синтезируемых в них фенольных соединений, тогда как их качественный состав во всех случаях одинаков.
ЛИТЕРАТУРА
|
|